
L’efficacia dei probiotici nel trattamento della malattia parodontale
Elisa Folini RDH MSc, Gianluca Russo RDH MSc, Saverio Cosola DDS MSc PhD, Giacomo Oldoini RDH MSc MSc, Annamaria Genovesi RDH DHA MSc
Introduzione
La parodontite è una malattia cronica multifattoriale che coinvolge una cascata di reazioni infiammatorie indotte da un microbiota parodontale disbiotico e caratterizzate dalla distruzione del tessuto parodontale e dal riassorbimento dell’osso alveolare. Ha un alta prevalenza a livello mondiale1, 2 e la sua gestione ha lo scopo di ridurre il livello di carica microbica e promuovere la guarigione del tessuto parodontale.
Recenti studi microbiologici supportano un nuovo modello di patogenesi della parodontite basato su un modello di sinergia polimicrobica e disbiosi (PSD), secondo il quale la malattia inizia da uno squilibrio tra l’ospite e la microflora in cui delle specie chiave (come Porphyromonas Gingivalis, Tannerella Forsythia e la Treponema Denticola3) in grado di compromettere la sorveglianza immunitaria dell’ospite ed elevare la patogenicità del microbiota, selezionano un microbiota infiammofilico che sostiene l’infiammazione parodontale4-6.
L’approccio tradizionale al trattamento della malattia parodontale include la distruzione meccanica del biofilm e la rimozione dei fattori ritentivi grazie alla terapia parodontale non chirurgica, considerata il “gold standard” del trattamento parodontale7, 8. Tuttavia la No Surgical Periodontal Therapy nonostante sia stata dimostrata efficace nella riduzione della profondità di tasca e nel migliorare il livello di attacco clinico9, 10 è limitata sia per motivi di accesso anatomico, tasche molto profonde e forcazioni, sia per motivi microbiologici, in quanto la ricolonizzazione dei siti da parte dei patogeni parodontali è frequente11. È stato infatti definito avere esiti risolutivi soltanto nel 75% delle tasche parodontali presenti. Pertanto, per potenziarne i risultati sono state proposte delle terapie coadiuvanti la terapia meccanica che includono: antibiotici, laser e probiotici.
I probiotici sono microrganismi che esercitano “effetti benefici sulla salute dell’ospite quando se ne viene somministrata una quantità sufficiente” 12, essi si propongono di ripristinare l’equilibrio microbiologico orale aumentando la popolazione dei batteri benefici attraverso l’inibizione competitiva dei patogeni parodontali, modulando poi la successiva risposta dell’ospite13.
Sicché, l’utilizzo di batteri probiotici potrebbe portare un potenziale beneficio nella gestione della malattia parodontale, diversi studi clinici hanno indagato i loro effetti in aggiunta alla NSPT, ma ciò nonostante sono pochi i dati riguardanti l’impatto clinico e gli esiti microbiologico e immunologico a lungo termine. È quindi necessario capire quali fattori possono influenzare l’efficacia dei probiotici nella terapia parodontale e quanto a lungo persiste un effetto potenzialmente benefico, permettendo di capire le modalità di applicazione in aggiunta alla NSPT. La presente revisione sistematica mira a valutare l’efficacia degli effetti dei probiotici in aggiunta alla NSPT comparati ai controlli con follow-up di outcomes clinici, microbiologici e immunologici.
Scopo
Lo scopo della revisione condotta è stato quello di rispondere alle seguenti domande:
- I probiotici forniscono effetti terapeutici aggiuntivi sugli esiti clinici, microbici e immunologici se usati in aggiunta alla terapia parodontale non chirurgica classica?
- Gli effetti aggiuntivi dei probiotici in aggiunta al NSPT persistono durante un follow-up a lungo termine?
Materiali e metodi
Questa revisione sistematica della letteratura ha seguito le linee guida per la meta-analisi e gli elementi predefiniti di report per le revisioni sistematiche (PRISMA). Per la ricerca bibliografica sono stati usati i seguenti database elettronici: PubMed, Medline and Cochrane Library dal 1 Aprile 2021 all’1 Novembre 2021. È stata eseguita la ricerca manuale delle seguenti riviste: Journal of Clinical Periodontology.
Disegno dello studio
I criteri di eleggibilità per l’inclusione sono Randomized Controlled Trials (RCT), Systematic Review e Meta-analysis con un periodo minimo di durata del follow-up di 3 mesi. Pubblicati dall’1 Novembre 2016 al 1 Novembre 2021. Sono stati esaminati i titoli e gli abstract per verificarne l’ammissibilità e sono stati inclusi solo gli studi che hanno soddisfatto i criteri di inclusione.
Selezione dello studio
La selezione degli studi per l’ammissibilità si è basata sul formato PICO come segue:
- Population: Pazienti adulti con diagnosi di parodontite Stadio III o IV.
- Intervention: Utilizzo di probiotici come terapia aggiuntiva alla no-surgical peridontal therapy (NSPT+Probiotics come Test Group).
- Comparator: Studi che riportano la presenza di un gruppo controllo/comparatore che riceve NSPT con placebo o senza nessun intervento probiotico (sola NSPT come Control Group).
- Outcomes: I principali esiti clinici considerati sono stati: la profondità di sondaggio della tasca (PPD), il livello di attacco clinico (CAL) e il sanguinamento al sondaggio (BOP). I risultati microbiologici invece hanno valutato le quantità assolute o l’abbondanza dei batteri patogeni parodontali e altre specie commensali orali.
Valutazione del rischio di bias
Ciascuno studio selezionato è stato valutato per il rischio di bias secondo The Cochrane Handbook for Systematic Reviews of Interventions20. Il rischio di bias e l’applicabilità alla domanda di ricerca sono stati valutati separatamente come preoccupazione alta, bassa o poco chiara per i seguenti domini:
- generazione di sequenze casuali;
- occultamento dell’allocazione;
- accecamento dei partecipanti e del personale;
- accecamento della valutazione dei risultati;
- dati sugli esiti incompleti;
- segnalazione selettiva;
- altre fonti di bias.
Gli studi sono stati classificati come a basso rischio se hanno soddisfatto tutti i criteri.
Risultati
Caratteristiche degli studi inclusi
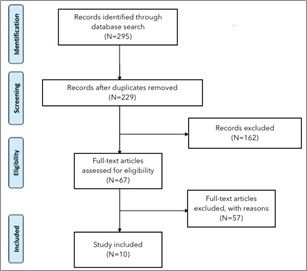
Il processo di selezione degli articoli è riassunto nella (Fig. 1). Un totale di 295 articoli è stato ottenuto dalla ricerca nel database e uno studio è stato ottenuto da revisioni esterne. Dopo la rimozione degli articoli in duplicato, sono stati esaminati 229 articoli e ne sono stati esclusi dopo lo screening di titolo e abstract 162, dei 67 rimanenti, gli articoli risultati conformi al criterio di inclusione sono stati 1021-30.
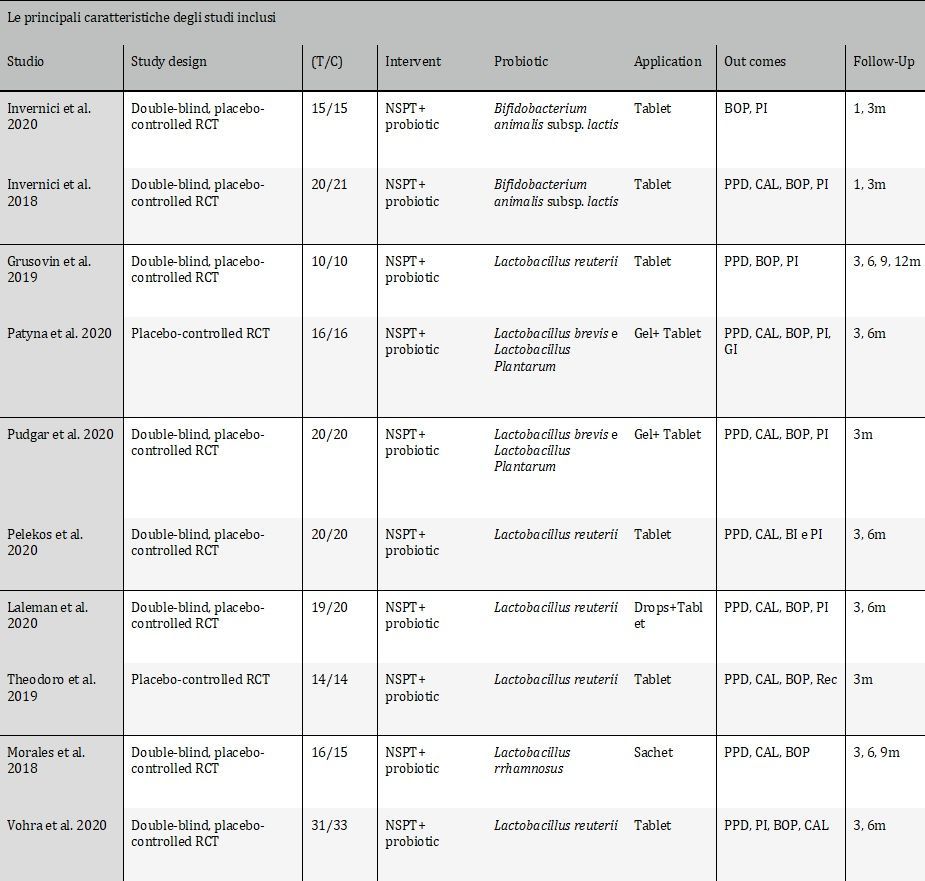
Tra questi studi, otto studi21-23, 25-27, 29-30 erano RCT in doppio cieco, controllati con placebo e due studi24, 28 erano RCT controllati con placebo. L’anno di pubblicazione variava dal 2018 al 2020. I soggetti selezionati negli studi presentavano un quadro di salute sistemica e una diagnosi di malattia parodontale di Stage II, III o IV (Chicago Work Shop-2017) e due studi hanno incluso soggetti fumatori. Tutti i pazienti hanno ricevuto un trattamento di NSPT con probiotici o con placebo. Due studi24, 29 hanno analizzato un terzo gruppo di pazienti valutando gli effetti aggiuntivi di antibiotico o del laser. Il periodo di follow-up degli studi inclusi va da 1 a 12 mesi. Cinque studi23, 26-28, 30 hanno utilizzato come probiotico Lactobacillus reuterii; due studi21, 22 hanno utilizzato Bifidobacterium animalis subsp. lactis; due studi24, 25 hanno utilizzato Lactobacillus brevis e Lactobacillus Plantarum e un altro studio29 ha utilizzato Lactobacillus rhamnosus. Cinque studi21, 22, 24, 27, 29 hanno riportato esiti microbilogici. Tutti gli studi hanno somministrato per via orale, in pastiglie o bustine, il probiotico, mentre solo tre24, 25, 27 hanno applicato a livello sottogengivale, in gel o gocce, durante la seduta professionale una soluzione probiotica aggiuntiva.
Non sono stati riportati eventi avversi dell’intervento probiotico in tutti gli studi. Inoltre, la maggior parte degli studi ha dimostrato che tutti o parte dei parametri clinici erano significativamente ridotti in entrambi i gruppi, mentre l’uso aggiuntivo di probiotici offriva un beneficio clinico più significativo rispetto al placebo. Tuttavia, alcuni studi hanno rilevato che l’uso aggiuntivo di probiotici ha comportato un beneficio clinico simile rispetto al placebo23-25, 28, 30. Tutti gli studi sono stati classificati a basso rischio in tutte le categorie. Tutti gli studi hanno chiarito le procedure di generazione di sequenze casuali, randomizzazione, occultamento e accecamento (Tab. 1).
Meta-analisi complessive
Profondità di tasca (PPD): Nove studi22-30 hanno fornito dati sugli effetti dei probiotici rispetto alla riduzione di PD al sondaggio. Tutti gli studi che hanno preso in osservazione questo parametro hanno notato una maggior riduzione della profondità di tasca nel Test Group, rispetto al Control Group a 3 mesi; definendo quindi anche un importante omogeneità tra gli studi considerati. Tuttavia solo sei studi23, 24, 26, 27, 29, 30 hanno riportato dati a sei mesi e quattro di questi non hanno osservato alcuna differenza significativa nella riduzione della PD rispetto al baseline e ai risultati a 3 mesi.
Livello di attacco Clinico (CAL): Otto studi22, 24-30 hanno fornito dati sugli effetti dei probiotici rispetto all’aumento di CAL. In sette studi22, 24-27, 29, 30 l’indice a 3 mesi ha registrato un guadagno aggiuntivo nei soggetti trattati con probiotici rispetto ai soggetti sottoposti alla sola terapia tradizionale e soltanto uno studio28 non ha registrato differenze significative tra un gruppo e l’altro. In cinque di questi24, 26, 27, 29, 30 l’indice è stato valutato a 6 mesi e in due di questi26, 30 i risultati sono stati paragonabili tra i due gruppi o comparabili al baseline.
Sanguinamento al sondaggio (BOP): Tutti gli studi21-30 hanno indagato questo Outcomes in correlazione con gli effetti probiotici: Due studi26, 29 non hanno registrato nessun miglioramento di BOP né a 3 né a 6 mesi; mentre gli altri studi hanno riscontrato un significativo miglioramento del parametro sia a breve (3 mesi) che a lungo termine (9 mesi), come nel caso di Grusovin-2019.
Indice di placca (PI): Sette studi21-27 hanno riportato dati circa l’indice di placca, il quale è stato registrato essere diminuito in tutti gli studi sia a breve termine che a lungo termine senza però mostrare significative differenza tra il Gruppo Test e il Gruppo Controllo.
Recessione Gengivale (Rec): Tre studi22, 25, 28 hanno valutato la recessione gengivale nel Gruppo Test e nel Gruppo Controllo a breve termine, ma nessuno di questi l’ha valutato con un termine temporale maggiore. In tutti e tre gli studi i livelli di recessione si sono mantenuti simili tra i due gruppi e non hanno mostrato differenze significative a livello statistico.
Indice Gengivale (GI): Soltanto uno studio24ha preso in considerazione il parametro all’indice gengivale e ha fornito dati sia a 3 che a 6 mesi. L’analisi ha mostrato un miglioramento in entrambi i momenti temporali dell’indice nei soggetti trattati con aggiunta di trattamento probiotico rispetto ai soggetti non trattati.
Discussione
Questa revisione sistematica mirava a valutare se i probiotici possono fornire un effetto terapeutico aggiuntivo e duraturo alla NSPT nei pazienti con parodontite. Per rispondere alla domanda principale, la revisione ha mostrato un impatto clinico positivo sugli outcomes clinici a 3 mesi, che è apparso però scarno nella quantità degli studi e contraddittorio nei risultati a 6 mesi. Considerati gli endpoint della suddetta revisione, la scarsità di dati a più di 3 mesi ha impedito ulteriori analisi a time-point più lunghi e ha precluso qualsiasi conclusione sugli effetti microbiologici a lungo termine.
Per quanto invece riguarda la contraddittorietà dei risultati a 6 mesi uno studio31 ha suggerito che la colonizzazione orale dopo il periodo di intervento si riduce nel tempo e, a volte, non è rilevabile in alcuni pazienti. Di interesse sono anche i risultati di uno studio32 che ha riportato la presenza di Lactobacillus Reuteri a 3 mesi, ma non a 6; indicando quindi che i suoi effetti potrebbero durare pochi mesi. Infatti lo studio di Vohra-2020 ha mostrato un miglioramento significativo dei parametri clinici a 3 mesi e di contro un ritorno ai valori di baseline dopo 6. Questi dati potrebbero riflettere il famoso wash-out dell’effetto benefico probiotico con il tempo26. Per ovviare all’effetto wash-out è possibile applicare regimi di somministrazione pulsata, che ripetono i cicli probiotici a distanza. Ne è una dimostrazione lo studio di Grusovin-2019 dove le somministrazioni pulsate a distanza di 3 mesi l’una dall’altra hanno sostenuto risultati riportati a 12 mesi. È inoltre presumibile che la grande differenza nella resistenza alla colonizzazione tra i pazienti, sia dovuta a variazioni genetiche dell’ospite. Da questo punto di vista, sono quindi necessari ulteriori studi per valutare come funziona il processo di colonizzazione parodontale nel tempo e per quanto tempo può essere mantenuto l’effetto dei probiotici e quindi può determinare la frequenza e il corso per una somministrazione ottimale.
Il limite di questa revisione era l’elevata eterogeneità tra gli studi. Gli studi si differenziavano per gravità dei parametri clinici al baseline e per follow-up oltre che per differenza di terapia probiotica con ceppi, posologia, durata e via di somministrazione differente (Tab. 2). Poiché ciascuno di questi fattori è una potenziale fonte di eterogeneità, ulteriori meta-analisi che affrontino gli aspetti summenzionati sono giustificate quando saranno disponibili più dati in studi futuri. Alcuni autori già nelle revisioni sistematiche precedenti (Ince-2015, Iniesta-2012, Krasse-2006, Tekce-2015, Teughels-2013, Vicario-2013) riportano difficoltà nel confrontare i risultati con altri studi a causa della divergenza delle metodologie utilizzate negli studi clinici con probiotici. È importante notare che nessuno degli studi ha riportato un dosaggio soglia per quanto riguarda l’efficacia dei probiotici nel trattamento della malattia parodontale. Inoltre, la frequenza di utilizzo dei probiotici variava tra gli studi inclusi. Rimane poco chiaro un dosaggio e una frequenza precisi del farmaco che produrrebbero l’esito clinico più favorevole32-35. Sono necessari ulteriori studi per esplorare un protocollo di somministrazione ottimale e gli studi futuri dovrebbero affrontare la gravità della malattia insieme ad altri fattori multipli e misure di esito per identificare gli individui che hanno maggiori probabilità di beneficiare di probiotici aggiuntivi.
In tutti gli studi analizzati sia il Gruppo Controllo che il Gruppo Test hanno promosso miglioramenti negli outcomes clinici, ma nessuno è stato tanto significativo rispetto all’altro da definirne una significatività statistica. Questa revisione però aveva diversi limiti. In primo luogo, la dimensione del campione era relativamente limitata, il che può comportare un’efficienza statistica insufficiente.
Meta-analisi complessive
Profondità di tasca (PPD): Nove studi22-30 hanno fornito dati sugli effetti dei probiotici rispetto alla riduzione di PD al sondaggio. Tutti gli studi che hanno preso in osservazione questo parametro hanno notato una maggior riduzione della profondità di tasca nel Test Group, rispetto al Control Group a 3 mesi; definendo quindi anche un importante omogeneità tra gli studi considerati. Tuttavia solo sei studi23, 24, 26, 27, 29, 30 hanno riportato dati a sei mesi e quattro di questi non hanno osservato alcuna differenza significativa nella riduzione della PD rispetto al baseline e ai risultati a 3 mesi.
Livello di attacco Clinico (CAL): Otto studi22, 24-30 hanno fornito dati sugli effetti dei probiotici rispetto all’aumento di CAL. In sette studi22, 24-27, 29, 30 l’indice a 3 mesi ha registrato un guadagno aggiuntivo nei soggetti trattati con probiotici rispetto ai soggetti sottoposti alla sola terapia tradizionale e soltanto uno studio28 non ha registrato differenze significative tra un gruppo e l’altro. In cinque di questi24, 26, 27, 29, 30 l’indice è stato valutato a 6 mesi e in due di questi26, 30 i risultati sono stati paragonabili tra i due gruppi o comparabili al baseline.
Sanguinamento al sondaggio (BOP): Tutti gli studi21-30 hanno indagato questo Outcomes in correlazione con gli effetti probiotici: Due studi26, 29 non hanno registrato nessun miglioramento di BOP né a 3 né a 6 mesi; mentre gli altri studi hanno riscontrato un significativo miglioramento del parametro sia a breve (3 mesi) che a lungo termine (9 mesi), come nel caso di Grusovin-2019.
Indice di placca (PI): Sette studi21-27 hanno riportato dati circa l’indice di placca, il quale è stato registrato essere diminuito in tutti gli studi sia a breve termine che a lungo termine senza però mostrare significative differenza tra il Gruppo Test e il Gruppo Controllo.
Recessione Gengivale (Rec): Tre studi22, 25, 28 hanno valutato la recessione gengivale nel Gruppo Test e nel Gruppo Controllo a breve termine, ma nessuno di questi l’ha valutato con un termine temporale maggiore. In tutti e tre gli studi i livelli di recessione si sono mantenuti simili tra i due gruppi e non hanno mostrato differenze significative a livello statistico.
Indice Gengivale (GI): Soltanto uno studio24ha preso in considerazione il parametro all’indice gengivale e ha fornito dati sia a 3 che a 6 mesi. L’analisi ha mostrato un miglioramento in entrambi i momenti temporali dell’indice nei soggetti trattati con aggiunta di trattamento probiotico rispetto ai soggetti non trattati.
Discussione
Questa revisione sistematica mirava a valutare se i probiotici possono fornire un effetto terapeutico aggiuntivo e duraturo alla NSPT nei pazienti con parodontite. Per rispondere alla domanda principale, la revisione ha mostrato un impatto clinico positivo sugli outcomes clinici a 3 mesi, che è apparso però scarno nella quantità degli studi e contraddittorio nei risultati a 6 mesi. Considerati gli endpoint della suddetta revisione, la scarsità di dati a più di 3 mesi ha impedito ulteriori analisi a time-point più lunghi e ha precluso qualsiasi conclusione sugli effetti microbiologici a lungo termine.
Per quanto invece riguarda la contraddittorietà dei risultati a 6 mesi uno studio31 ha suggerito che la colonizzazione orale dopo il periodo di intervento si riduce nel tempo e, a volte, non è rilevabile in alcuni pazienti. Di interesse sono anche i risultati di uno studio32 che ha riportato la presenza di Lactobacillus Reuteri a 3 mesi, ma non a 6; indicando quindi che i suoi effetti potrebbero durare pochi mesi. Infatti lo studio di Vohra-2020 ha mostrato un miglioramento significativo dei parametri clinici a 3 mesi e di contro un ritorno ai valori di baseline dopo 6. Questi dati potrebbero riflettere il famoso wash-out dell’effetto benefico probiotico con il tempo26. Per ovviare all’effetto wash-out è possibile applicare regimi di somministrazione pulsata, che ripetono i cicli probiotici a distanza. Ne è una dimostrazione lo studio di Grusovin-2019 dove le somministrazioni pulsate a distanza di 3 mesi l’una dall’altra hanno sostenuto risultati riportati a 12 mesi. È inoltre presumibile che la grande differenza nella resistenza alla colonizzazione tra i pazienti, sia dovuta a variazioni genetiche dell’ospite. Da questo punto di vista, sono quindi necessari ulteriori studi per valutare come funziona il processo di colonizzazione parodontale nel tempo e per quanto tempo può essere mantenuto l’effetto dei probiotici e quindi può determinare la frequenza e il corso per una somministrazione ottimale.
Il limite di questa revisione era l’elevata eterogeneità tra gli studi. Gli studi si differenziavano per gravità dei parametri clinici al baseline e per follow-up oltre che per differenza di terapia probiotica con ceppi, posologia, durata e via di somministrazione differente (Tab. 2). Poiché ciascuno di questi fattori è una potenziale fonte di eterogeneità, ulteriori meta-analisi che affrontino gli aspetti summenzionati sono giustificate quando saranno disponibili più dati in studi futuri. Alcuni autori già nelle revisioni sistematiche precedenti (Ince-2015, Iniesta-2012, Krasse-2006, Tekce-2015, Teughels-2013, Vicario-2013) riportano difficoltà nel confrontare i risultati con altri studi a causa della divergenza delle metodologie utilizzate negli studi clinici con probiotici. È importante notare che nessuno degli studi ha riportato un dosaggio soglia per quanto riguarda l’efficacia dei probiotici nel trattamento della malattia parodontale. Inoltre, la frequenza di utilizzo dei probiotici variava tra gli studi inclusi. Rimane poco chiaro un dosaggio e una frequenza precisi del farmaco che produrrebbero l’esito clinico più favorevole32-35. Sono necessari ulteriori studi per esplorare un protocollo di somministrazione ottimale e gli studi futuri dovrebbero affrontare la gravità della malattia insieme ad altri fattori multipli e misure di esito per identificare gli individui che hanno maggiori probabilità di beneficiare di probiotici aggiuntivi.
In tutti gli studi analizzati sia il Gruppo Controllo che il Gruppo Test hanno promosso miglioramenti negli outcomes clinici, ma nessuno è stato tanto significativo rispetto all’altro da definirne una significatività statistica. Questa revisione però aveva diversi limiti. In primo luogo, la dimensione del campione era relativamente limitata, il che può comportare un’efficienza statistica insufficiente.
Bibliografia
- Hajishengallis G, Liang S, Payne MA, et al. Low-abundance biofilm species orchestrates inflammatory periodontal disease through the commensal microbiota and complement. Cell Host Microbe 2011;10(5):497-506.
- Jin LJ, Lamster IB, Greenspan JS, Pitts NB, Scully C, Warnakulasuriya S. Global burden of oral diseases: emerging concepts, management and interplay with systemic health. Oral Dis 2016;22(7):609-19.
- Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL Jr. Microbial complexes in subgingival plaque. J Clin Periodontol 1998;25(2):134-44.
- Huang N, Gibson FC 3rd. Immuno-pathogenesis of periodontal disease: current and emerging paradigms. Curr Oral Health Rep 2014;1(2):124-32.
- Hajishengallis, G. & Lamont, R. J. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol. Oral. Microbiol. 27, 409–419.
- Hajishengallis, G. The inflammophilic character of the periodontitis-associated microbiota. Mol. Oral. Microbiol. 29, 248–257.
- Aimetti M. Nonsurgical periodontal treatment. Int J Esthet Dent 2014;9(2):251-67.
- Cobb CM. Clinical significance of non-surgical periodontal therapy: an evidence-based perspective of scaling and root planing. J Clin Periodontol 2002;29(suppl 2):6-16.
- VanderWeijden, G.A.&Timmerman, M.F. A systematic review on the clinical efficacy of subgingival debridementinthetreatment of chronic periodontitis. J. Clin. Periodontol. 29 (Suppl 3), 55–71; discussion 90–51 (2002).
- Cobb,C.M.Clinical significance of non-surgical periodontal therapy: an evidence-based perspective of scaling and rootplaning. J. Clin. Periodontol. 29(Suppl 2), 6–16 (2002).
- Haffajee AD, Teles RP, Socransky SS. The effect of periodontal therapy on the composition of the subgingival microbiota. Periodontol 2000. 2006;42:219-58.
- Food and Agriculture Organization of the United Nations/ World Health Organization. Guidelines for the evaluation of probiotics in food. 2002 (https://www.who.int/foodsafety/ fs_management/en/probiotic_guidelines.pdf);
- Allaker RP, Stephen AS. Use of probiotics and oral health. Curr Oral Health Rep 2017;4(4):309-18.
- Ryan CS, Kleinberg I. Bacteria in human mouths involved in the production and utilization of hydrogen peroxide. Arch Oral Biol. 1995;40(8):753–763. 15.
- Gupta R, Srivastava S. Antifungal effect of antimicrobial peptides (AMPs LR14) derived from Lactobacillus plantarum strain LR/14 and their applications in prevention of grain spoilage. Food Microbiol. 2014;42:1–7.
- Gillor O, Etzion A, Riley MA. The dual role of bacteriocins as anti- and probiotics. Appl Microbiol Biotechnol. 2008;81(4):591–606.
- Parker EA, Roy T, D’Adamo CR, Wieland LS. Probiotics and gastrointestinal conditions: an overview of evidence from the Cochrane Collaboration. Nutrition 2018;45:125-134.e11.
- Zmora N, Zilberman-Schapira G, Suez J, et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell 2018;174(6):1388-1405.e21.
- Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta- analyses: the PRISMA statement. PLoS Med 2009;6(7):e1000097.
- Higgins JPT, Green S. Assessing risk of bias in included studies. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. Available at: http:// handbook-5-1.cochrane.org/chapter_8/8_assessing_risk_of_bias_ in_included_studies.htm. Accessed June 11, 2019.
- Invernici MM, Furlaneto FAC, Salvador SL, et al. Bifidobac- terium animalis subsp lactis HN019 presents antimicrobial po- tential against periodontopathogens and modulates the im- munological response of oral mucosa in periodontitis patients. PLoS ONE. 2020;15(9).
- Invernici MM, Salvador SL, Silva PHF, et al. Effects of Bi- fidobacterium probiotic on the treatment of chronic pe- riodontitis: a randomized clinical trial. J Clin Periodontol. 2018;45(10):1198–1210.
- Grusovin MG, Bossini S, Calza S, Cappa V, Garzetti G, Scotti E, Gherlone EF, Mensi M. Clincal Efficacy of Lactobacillus reuteri-containing lozenges in the supportive therapy of generalized periodontitis stage III and IV, grade C: 1-year results of a double-blind randomized placebo-controlled pilot study. Clin Oral Investig. 2020;24(6):2015-2024.
- Patyna M, Ehlers V, Bahlmann B, Kasaj A. Effects of adjunctive light-activated disinfection and probiotics on clinical and microbiological parameters in periodontal treatment: a randomized, controlled, clinical pilot study. Clin Oral Investig. 2020.
- Pudgar P, Povsic K, Cuk K, Seme K, Petelin M, Gaspersic R. Probiotic strains of Lactobacillus brevis and Lactobacillus plan- tarum as adjunct to non-surgical periodontal therapy: 3-month results of a randomized controlled clinical trial. Clin Oral Investig. 2020.
- Pelekos g, Acharya A, Eiji N, Hong G, Leung WK, McGrath C. Effects of adjunctive probiotic L. reuteri lozenges on S/RSD outcomes at molar sites with deep pockets. J Clin Periodontol. 2020.
- Laleman I, Pauwels M, Quirynen M, Teughels W. A dual-strain Lactobacilli reuteri probiotic improves the treatment of residual pockets: a randomized controlled clinical trial. J Clin Periodon- tol. 2020;47(1):43–53.
- Theodoro LH, Claudio MM, Nuernberg MAA, Miessi DMJ, Batista JA, Duque C, Garcia VG. Effects of Lactobacillus reuteri as an adjunct to the treatment of periodontitis in smokers: randomised clinical trial. Benef Microbes. 2019.
- Morales A, Gandolfo A, Bravo J, et al. Microbiological and clin- ical effects of probiotics and antibiotics on nonsurgical treat- ment of chronic periodontitis: a randomized placebo- con- trolled trial with 9-month follow-up. J Appl Oral Sci. 2018;26.
- Vohra F, Bukhari IA, Sheikh SA, Albaijan R, Naseem M, Hus- sain M. Effectiveness of scaling and root planing with and with- out adjunct probiotic therapy in the treatment of chronic peri- odontitis among shamma users and non-users: a randomized controlled trial. J Periodontol. 2020.
- KrasseP,CarlssonB,DahlC,PaulssonA,NilssonA,SinkiewiczG. Decreased gum bleeding and reduced gingivitis by the probiotic Lactobacillus reuteri. Swed Dent J 2006;30(2):55-60.
- Tekce M, Ince G, Gursoy H, et al. Clinical and microbiological effects of probiotic lozenges in the treatment of chronic peri- odontitis: a 1-year follow-up study. J Clin Periodontol. 2015;42(4): 363–372.
- Vivekananda M, Vandana K, Bhat K. Effect of the probiotic Lactobacilli reuteri (Prodentis) in the management of periodontal disease: a preliminary randomized clinical trial. J Oral Microbiol. 2010;2:5344.
- Ince G, Gursoy H, Ipci DS, Cakar G, Alturfan EE, Ylmaz S. Clinical and biochemical evaluation of lactobacillus reuteri containing loz- enges as an adjunct to nonsurgical periodontal therapy in chronic periodontitis. J Clin Periodontol. 2015;42:126.
- Szkaradkiewicz AK, Stopa J, Karpiński TM. Effect of oral admin- istration involving a probiotic strain of Lactobacillus reuteri on pro-inflammatory cytokine response in patients with chronic periodontitis.
Immagine di copertina by zinkevych - Freepik
https://www.managementodontoiatrico.it/a/igiene-orale/030423-parodontite/l-efficacia-dei-probiotici-nel-trattamento-della-malattia-parodontaleNuovo paragrafo







