Giacomo Oldoini*, Silvia Pelle*, Annamaria Genovesi*, Saverio Cosola*
Introduzione
La parodontite è una patologia infiammatoria cronica multifattoriale, caratterizzata da un processo di distruzione dei tessuti di sostegno del dente, con conseguente perdita degli elementi dentali1. Recenti studi definiscono un nuovo modello di patogenesi della parodontite, basato sull’alterazione del rapporto tra ospite e microbiota parodontale2. Il cavo orale ospita infatti un microbiota simbiotico, il quale esercita effetti benefici sull’ospite, poiché contrasta la colonizzazione da parte dei microrganismi patogeni, attenua la risposta infiammatoria dell’ospite e partecipa allo sviluppo fisiologico delle difese immunitarie del cavo orale3.
In condizioni patologiche però, questa relazione simbiotica viene meno e lascia il posto a uno stato di disbiosi, in cui la proporzione di specie batteriche trasla verso una maggiore prevalenza di specie in grado di elevare la patogenicità del microbiota (es. Porphyromonas gingivalis, Tannerella forsythia e la Treponema denticola) e di modulare la risposta dell’ospite, favorendo l’insorgenza di uno stato infiammatorio cronico4. Dal momento che un microbiota disbiotico costituisce fattore eziologico della malattia parodontale, l’eliminazione dei microrganismi patogeni rappresenta il primo obiettivo di un approccio terapeutico efficace, al fine di favorire il ritorno a un equilibrio microbilogico e ottenere una restitutio ad integrum. Il gold standard nel trattamento della malattia parodontale consiste infatti nella strumentazione meccanica sopra e sottogengivale, mediante scaling e root planing (SRP), eseguito tramite strumenti ultrasonici e manuali5.
Negli anni 90, Quirynen e collaboratori introdussero il protocollo One-Stage Full-Mouth Disinfection (OSFMD), il quale prevedeva una terapia parodontale non chirurgica effettuata in un periodo di 24 ore, al fine di limitare una eventuale contaminazione e reinfezione di tasche parodontali ancora non trattate, possibile rischio della strumentazione a quadranti, fino ad allora terapia di elezione6.
Nel 2014, uno studio condotto dalla Fondazione Istituto Stomatologico Toscano, ha proposto una versione modificata del protocollo OSFMD di Quirynen (MFMD), la quale prevede una fase domiciliare pre-trattamento (Tab. 1), volta a ridurre la carica batterica e l’infiammazione gengivale, creando così le condizioni per una strumentazione più confortevole per il paziente e più rapida ed efficace per l’operatore. È stato evidenziato come la riduzione dell’edema sia in grado di promuovere una strumentazione meno traumatica per i tessuti molli, ovvero più conservativa, con risultati estetici migliori, oltre a limitare la necessità di anestetico. Ne consegue poi un minor sanguinamento, ovvero una migliore visibilità e una ridotta liberazione di aerosol contaminato. In uno studio successivo sono stati evidenziati inoltre miglioramento degli indici di placca e di sanguinamento, aumento della compliance e riduzione del rischio di batteriemia7, 8. I vantaggi evidenziati, ci hanno portato a selezionare questo protocollo operativo come il più adatto per il presente case report

Nonostante la strumentazione meccanica rappresenti il gold standard nella terapia parodontale non chirurgica, alcuni fattori tra cui biofilm subgengivale residuo, fattori anatomici, profondità di tasca elevate e abilità di invasione dei tessuti parodontali da parte di alcuni patogeni, minano all’efficacia della stessa. Lo SRP riduce il sanguinamento fino al 63% dei siti trattati e determina risoluzione del 74% delle tasche parodontali (PPD ≤ 4mm e assenza di BoP)9, 10.
Questi fattori hanno portato molti ricercatori a valutare numerose terapie coadiuvanti la terapia meccanica, che possano incrementarne i risultati, tra cui la somministrazione in studio e/o a livello domiciliare di antimicrobici topici, quali la clorexidina11. Essa è stata somministrata come antimicrobico di elezione negli ultimi anni, data la sua attività ad ampio spettro. Sono stati evidenziati tuttavia effetti indesiderati quali pigmentazione delle superfici, secchezza delle fauci, alterazione del gusto, irritazione delle mucose; motivo per cui la somministrazione va limitata a brevi periodi (10-15 gg). La sua azione battericida, attiva indiscriminatamente contro Gram positivi e Gram negativi, rende più complesso l’equilibrio tra specie microbiologiche, elemento imprescindibile di una condizione di eubiosi12. Alla luce di quanto detto, la ricerca di nuovi trattamenti topici in grado di esplicare non solo proprietà antimicrobiche, ma anche altri effetti benefici e che siano sicuri in termini di istocompatibilità con i tessuti dell’ospite, è in continua crescita13.
In questo contesto, l’uso dell’ozono come antimicrobico, risulta essere particolarmente valido, motivo per cui è stato inserito nel protocollo pre-trattamento e di mantenimento del caso presentato. Il meccanismo d’azione alla base della sua attività antimicrobica consiste nell’ossidazione dei fosfolipidi e delle lipoproteine che costituiscono la membrana cellulare dei patogeni. Si verifica così la distruzione della membrana citoplasmatica, con conseguente infiltrazione del microrganismo da parte dell’ozono, il quale ne ossiderà glicoproteine e glicolipidi, bloccando la funzione enzimatica del patogeno. Questa azione è selettiva per le cellule microbiche e non danneggia le cellule dell’ospite, che presentano abilità antiossidanti più elevate14. Da una recente revisione emerge infatti l’elevato livello di biocompatibilità con le cellule epiteliali e i fibroblasti, oltre a effetti antiossidanti, analgesici, antiedemici, antiflogistici, e biostimolanti, proprietà che vengono accentuate a contatto con acqua (come nel cavo orale)15. L’ozono medico presenta inoltre proprietà antinfiammatorie e immunomodulatorie16. A basso dosaggio, il potere ossidante dell’ozono, stimola infatti l’attività antiossidante endogena e la produzione di interleuchine, leucotrieni e prostaglandine, molecole coinvolte nella riduzione dell’infiammazione e nei processi di guarigione tissutale17.
Anche il sistema immunitario, umorale e cellulo mediato, è influenzato dall’esposizione dei tessuti all’ozono. Esso stimola la proliferazione di linfociti e la sintesi delle immunoglobuline. Attiva, inoltre, i macrofagi e aumenta la sensibilità dei microrganismi patogeni alla fagocitosi18. L’ozono favorisce inoltre il trasporto di ossigeno nel sangue, migliorando così l’ossigenazione dei tessuti e favorendo il controllo dei processi infiammatori19. Tali effetti benefici rendono sempre più valida l’applicazione di ozono come trattamento coadiuvante nella gestione della malattia parodontale.
Recenti evidenze supportano il concetto per cui la risposta immunitaria e infiammatoria dell’ospite rientra tra le cause principali della distruzione dei tessuti parodontali e vengono influenzate da diversi fattori, i quali rendono il passaggio a microbiota disbiotico più probabile per alcuni pazienti rispetto ad altri e che possono influenzare la severità della malattia parodontale20. Nonostante la malattia parodontale trovi infatti esordio in presenza di un biofilm poli-microbico disbiotico, è ampiamente accettato come, in presenza della stessa microflora patogenetica, la suscettibilità alla malattia parodontale possa variare da un paziente ad un altro20, 21. Nell’ambito del trattamento della malattia parodontale è importante perciò l’associazione con una sostanza come l’ozono, vista le sue proprietà antinfiammatorie e anti-edemigene.
Come descritto in precedenza, in una condizione di disbiosi, la proporzione di specie batteriche trasla verso una maggiore prevalenza di specie anaerobiche e proteolitiche, in grado di determinare la formazione di tasche parodontali e perdita di attacco clinico22. In questo contesto, l’apporto di ossigeno nel sito parodontale tramite prodotti all’ozono, determina una modificazione nell’ambiente rendendolo più favorevole alla vita dei batteri aerobi, riducendo per competizione i batteri anaerobi, principali protagonisti nei processi di infiammazione parodontale. In questo modo, anche la ricolonizzazione del sito parodontale da parte dei patogeni parodontali viene ostacolata e ritardata23. Questo concetto rientra tra gli obiettivi fondamentali del trattamento parodontale non chirurgico, che non si deve limitare alla distruzione della componente batterica patogenetica, bensì volgere a un mantenimento a lungo termine di uno stato di equilibrio tra ospite e microbioma, potenziato dalla somministrazione di prodotti quali l’ozono, incluso nella fase di pre-trattamento e di mantenimento nell’ambito del protocollo OSFMD modificato dalla Prof.ssa Annamaria Genovesi.
La motivazione e l’istruzione del paziente a una corretta igiene domiciliare rappresentano infine requisiti fondamentali per un approccio volto alla preservazione della salute orale nel lungo periodo, in un contesto e di prevenzione e terapeutico24. Una delle maggiori sfide per il clinico è quella di ottenere la compliance del paziente e di rendere l’istruzione all’igiene orale domiciliare semplice ma efficace. In particolare, in termini di spazzolamento, la tecnica migliore sembra essere quella che garantisce completa rimozione di placca nel minor tempo possibile, senza causare danni ai tessuti molli25.
Per questo motivo, negli ultimi anni sono stati introdotti nel mercato diversi spazzolini elettrici, i quali non richiedono l’apprendimento di complesse tecniche di spazzolamento. Nel caso presentato, lo spazzolino selezionato è uno spazzolino sonico ad azione fluido-dinamica26.
Diversi studi hanno dimostrato che il movimento ad alta frequenza delle setole, sfruttando la corrente elettrica nei fluidi del cavo orale, determina la formazione transitoria di microbolle di aria che favoriscono la disgregazione del biofilm anche senza contatto diretto delle setole e anche a 2 mm dal margine gengivale27. L’associazione di prodotti pro-attivi, quali dentifrici all’ozono, permette loro, tramite l’azione fluidodinamica, di raggiungere siti normalmente complessi da raggiungere, favorendo così una potenziata modulazione del microbiota.
Caso clinico
Il caso clinico presentato riguarda una paziente di sesso femminile di 56 anni, ex fumatrice e in buona salute.
Prima seduta
Al baseline (t0), la paziente è stata sottoposta a:
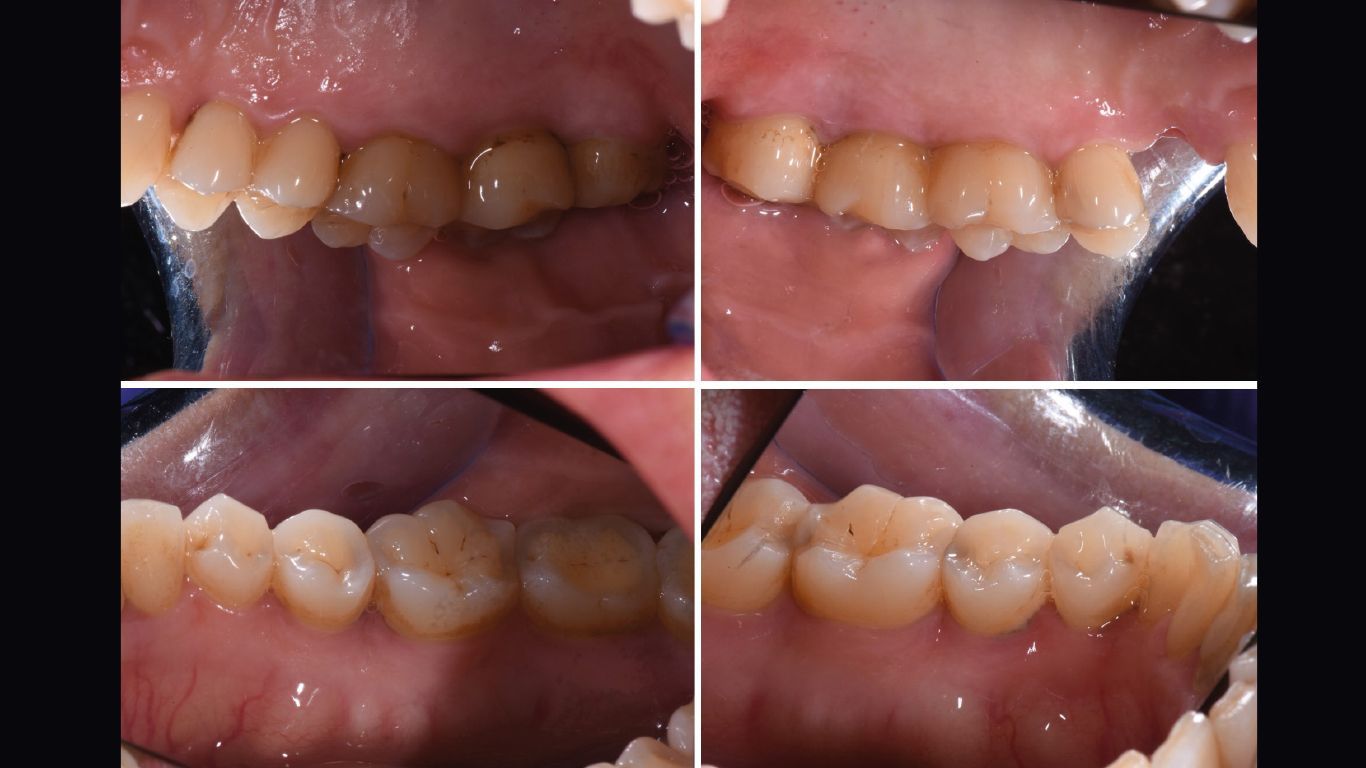
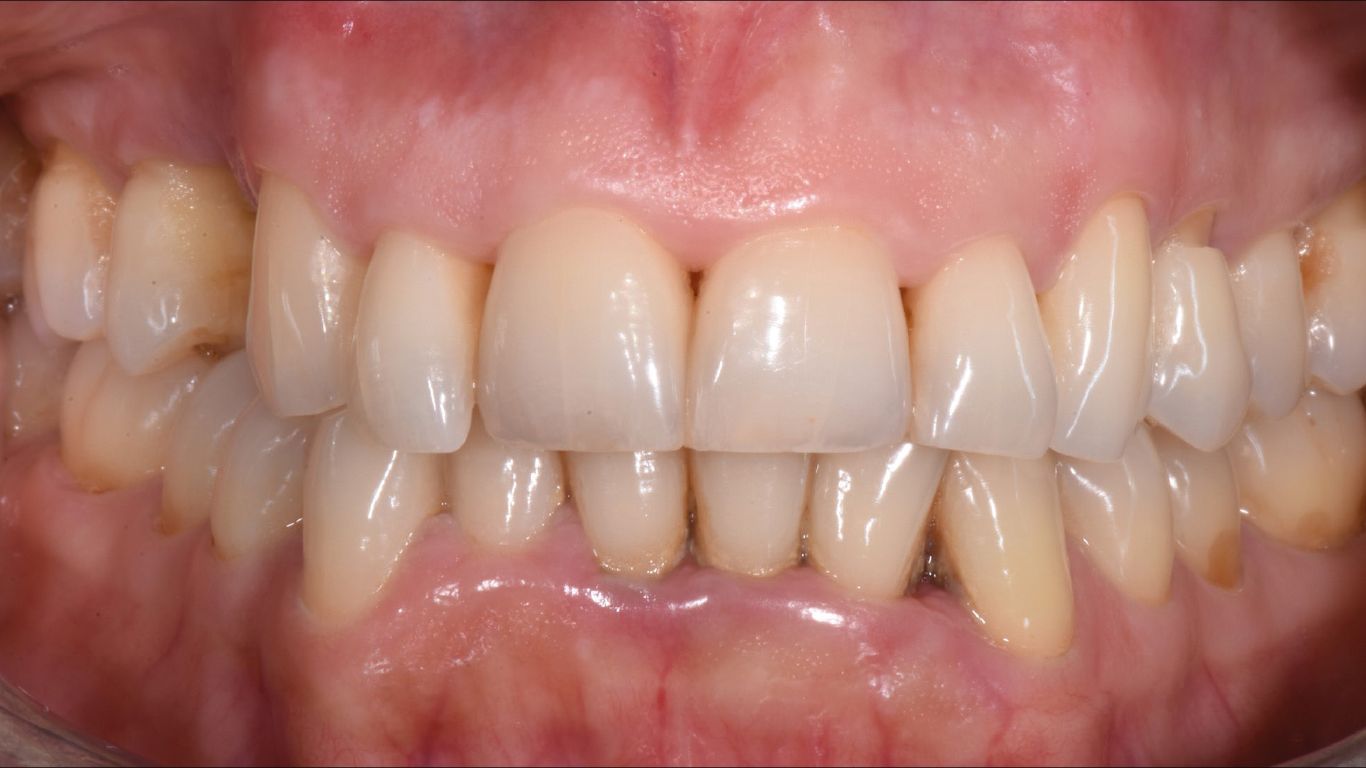
- status fotografico (Figg. 1, 2);
- valutazione anamnestica e del rischio parodontale;
- status radiografico (Fig. 3);
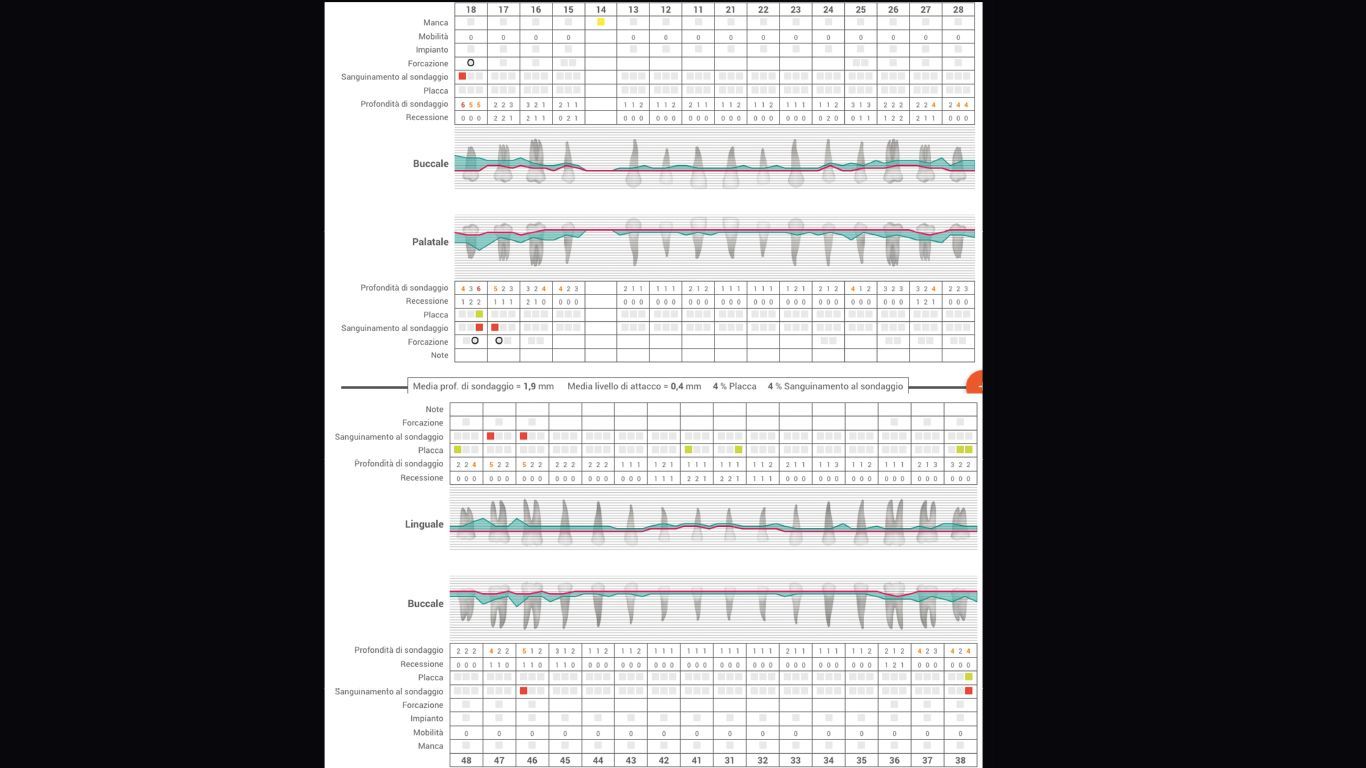
- charting parodontale (Figg. 4a, 4b).
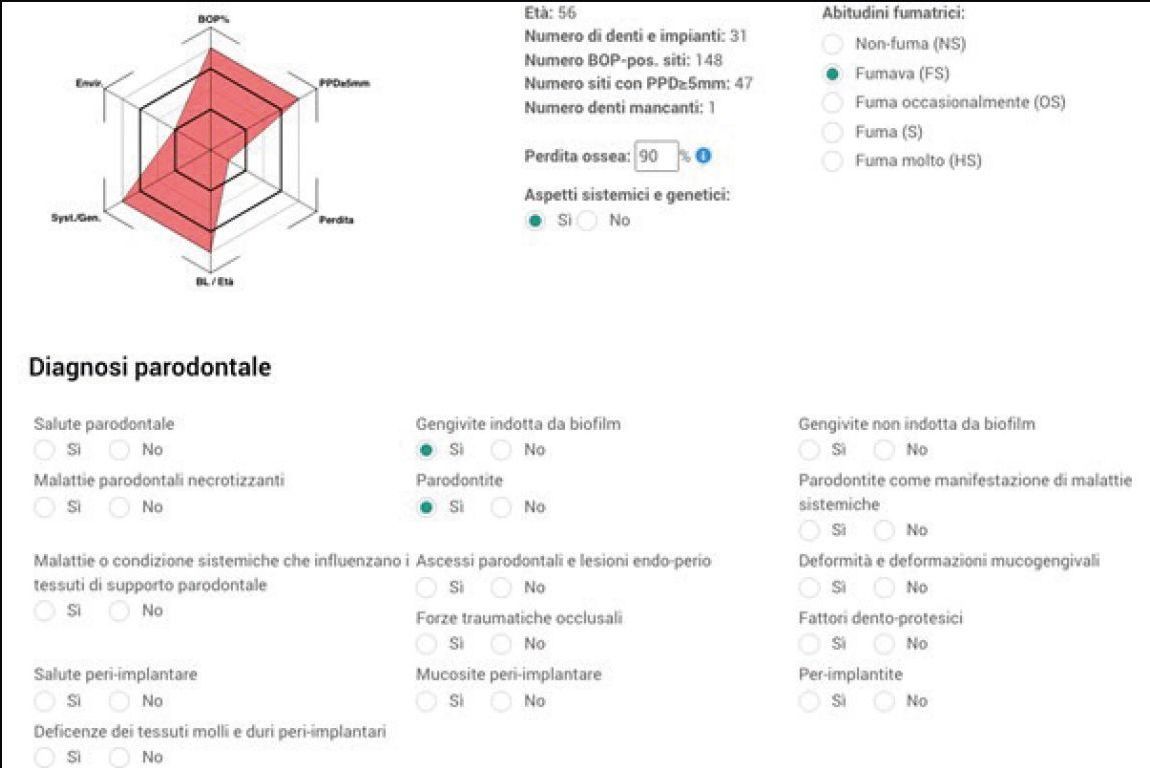
Fig. 4b
I dati raccolti hanno permesso il seguente inquadramento parodontale della paziente, sulla base della nuova classificazione della malattia parodontale31 (Fig. 4c). Si decide di procedere attraverso protocollo di Full-Mouth Disinfection Modificata (MFMD).

In questo caso però si è scelto di sottoporre la paziente a trattamento preventivo con prodotti a base di ozono, anziché a base di clorexidina, come previsto dal protocollo originale della Prof.ssa Genovesi. L’obiettivo era quello di modulare la risposta infiammatoria e di sfruttare l’effetto antiossidante e tutti gli effetti benefici dell’ozono precedentemente descritti, circoscrivendo invece l’uso dei prodotti a base di clorexidina alla fase post terapeutica e per un periodo non più lungo di 15 giorni12.
In occasione del baseline perciò, la paziente non è stata trattata meccanicamente ed è stata sottoposta a istruzione e motivazione a un’igiene orale scrupolosa per i successivi 15 giorni:
- istruzione all’utilizzo, almeno due volte al giorno, di uno spazzolino sonico Philips, ad azione fluidodinamica, la quale consente di veicolare il principio attivo dei prodotti utilizzati all’interno del solco parodontale e nelle zone più difficili da raggiungere con altri spazzolini;
- istruzione all’utilizzo, due volte al dì, di scovolini in silicone sia per gli spazi interdentali, sia con movimento verticale all’interno del solco gengivale, per favorire la disgregazione del biofilm anche nella tasca parodontale, potenziando l’effetto dello spazzolino sonico7;
- sciacqui due volte al dì con collutorio a base di ozono CollutO3 formulato al 4% di olio di semi di sesamo, il quale limita la volatilità del principio attivo e ne garantisce una stabilità più elevata rispetto altre formulazioni29;
- utilizzo due volte al dì, di dentifricio all’ozono DentO3, formulato al 2% di olio di semi di girasole, il quale limita la volatilità del principio attivo e ne garantisce una stabilità più elevata rispetto altre formulazioni29;
- utilizzo almeno una volta al dì, di gel orale Ozoral al 15% di olio di semi di girasole ozonizzato, da veicolare all’interno del solco gengivale e negli spazi interdentali, tramite scovolino in silicone.
Seconda seduta
Seconda seduta Dopo 15gg dal baseline (t1), la paziente è stata sottoposta nuovamente a documentazione fotografica (Fig. 5), rilevazione degli indici infiammatori e terapia attiva, come previsto dal protocollo MFMD: debridement ultrasonico delle aree parodontalmente compromesse con inserti perioanatomici;
- air polishing con polvere di glicina sopra e sottogengivale con inserti parodontali per forcazioni o anatomie radicolari che ne richiedessero l’impiego30;
- rifinitura con curettes universali perioanatomiche, a seguito di valutazione di eventuali residui sottogengivali con explorer;
- sciacqui a intervalli di 10 min. con collutorio alla clorexidina allo 0.20% non diluito; irrigazione tasche e solchi con gel alla clorexidina all’1%.
La seduta è stata facilitata dal mantenimento domiciliare e dal buon controllo di placca, con conseguente riduzione dell’infiammazione, perciò un maggior comfort per la paziente alla strumentazione. A seguito della terapia attiva, è stata eseguita nuovamente motivazione all’igiene orale e sono state rinnovate le istruzioni ripartite al baseline rispetto a spazzolino sonico e scovolini in silicone. I prodotti all’ozono sono stati invece provvisoriamente sostituiti con prodotti a base di clorexidina.
Alla paziente sono stati prescritti, per 10 giorni:
- collutorio alla clorexidina allo 0,12% (Curasept collutorio 0,12% Ads+DNA), 2 volte al giorno;
- dentifricio gel alla clorexidina allo 0,20% (Curasept clorexidina 0,20% Ads+DNA), 2 volte al giorno.
A sospensione dei prodotti a base di clorexidina, la paziente ha ripreso a utilizzare collutorio e dentifricio all’ozono, 2 volte al giorno. Il razionale di questa scelta sta nel concetto precedentemente esposto, per cui a seguito di una fase re-attiva (clorexidina) atta a distruggere tutti i microrganismi presenti nel cavo orale, si passa a una fase pro-attiva, in cui l’ozono supporta e rinforza le difese immunitarie e aiuta a favorire la ricolonizzazione delle superfici da parte di batteri aerobi commensali, a scapito di batteri anaerobi, coinvolti nella patogenesi della malattia parodontale.
Terza/quarta seduta
A 20(t2) e a 40(t3) giorni dal t1 sono state effettuate visite di controllo intermedie, con lo scopo di rinforzare la motivazione della paziente e di valutare l’inserimento nelle manovre di igiene domiciliare di tools interdentali a misura e specifici per la paziente.
Quinta seduta
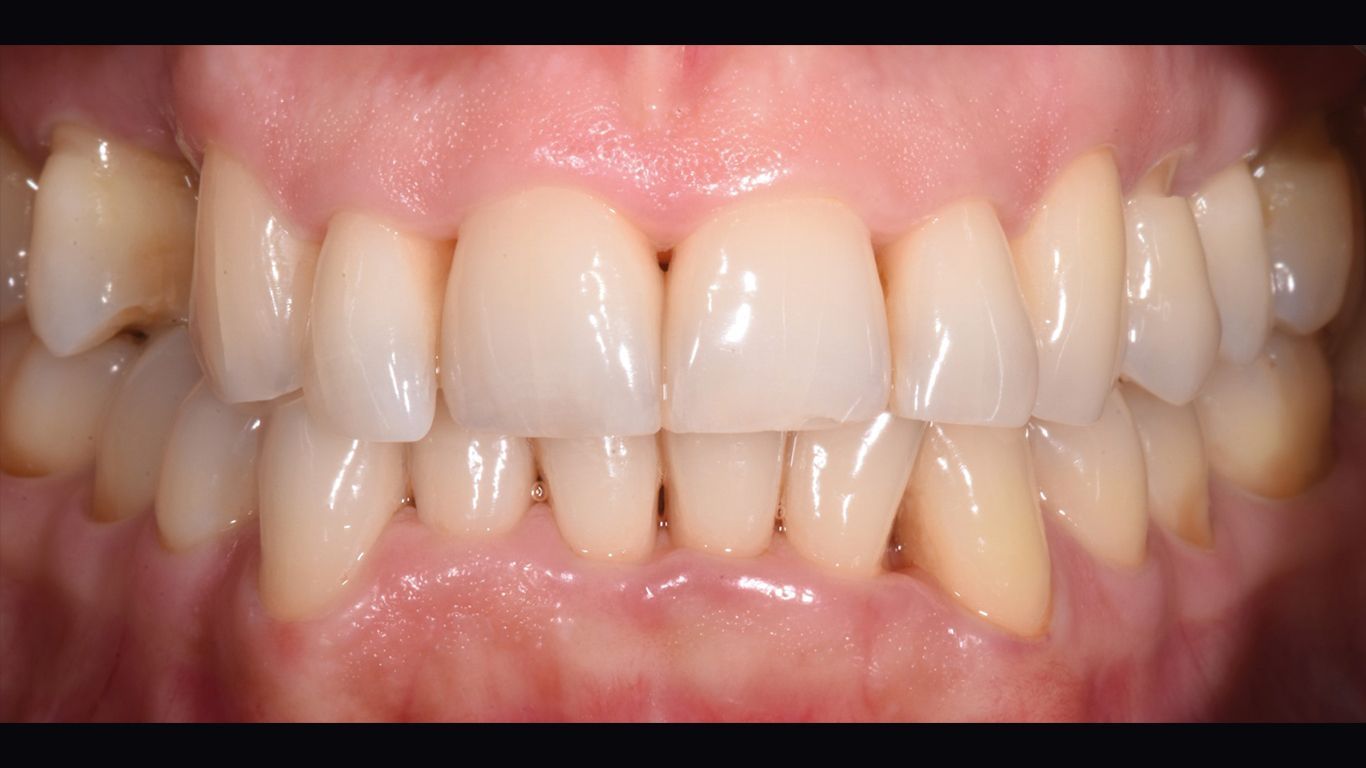
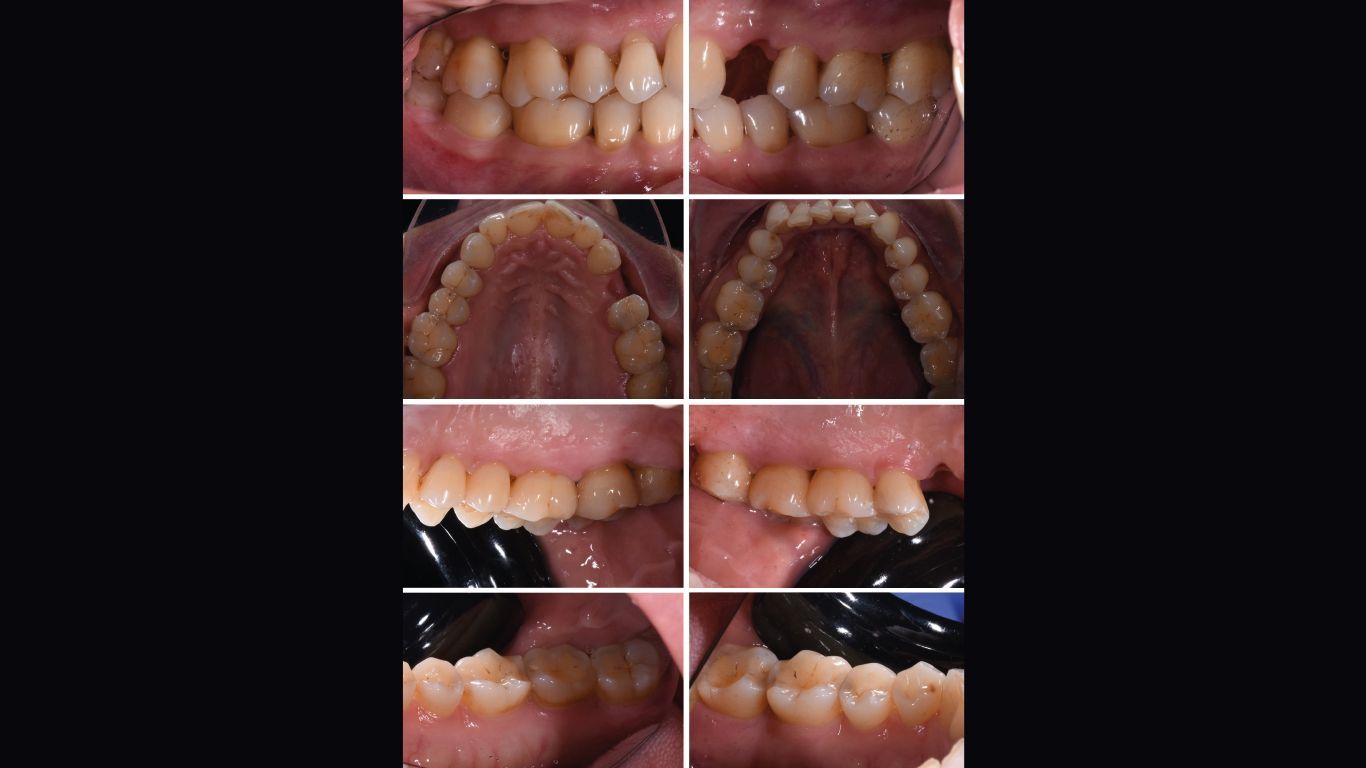
La rivalutazione è stata effettua a 60 giorni (t4) dal t1. È stata effettuata documentazione fotografica completa (Figg. 6, 7), charting parodontale (Fig. 8) e organizzazione dei follow up successivi, stabiliti con cadenza di 3/4 mesi per il primo anno post terapia. È stato inoltre eseguito air polishing con polvere di glicina sui siti ancora attivi.
Discussione
La terapia parodontale non chirurgica eseguita tramite SRP è considerata come il gold standard nel trattamento della parodontite31. Il protocollo MFMD, rendendo il paziente co-protagonista della terapia parodontale, è risultato essere efficace nel migliorare la percezione dello stesso rispetto all’importanza che una buona compliance ha nell’esito positivo del trattamento e, di conseguenza, nella fase di mantenimento32. Non solo, i benefici risultanti da una riduzione degli indici infiammatori e dell’accumulo di placca batterica, antecedente alla strumentazione, sembrerebbero ridurre la sintomatologia dolorosa e perciò la quantità di anestetico utilizzato, ma rendono anche la strumentazione meno traumatica, con esiti esteticamente migliori e minor sanguinamento, ovvero meno aerosol contaminato33.
Tali vantaggi sono stati riscontrati anche in questo caso. L’aspetto e la consistenza dei tessuti molli hanno ottenuto un notevole miglioramento dal baseline al t1 (Figg. 1, 5). La percentuale di siti positivi al sanguinamento al sondaggio (BoP) si è ridotta dall’80% al 67%, mentre la percentuale di placca batterica si è ridotta dall’80% al 54%, confermando così una tendenza positiva al miglioramento degli indici parodontali a seguito della fase di pre-trattamento. Nonostante ciò, il microbiota soppresso per gran parte dai prodotti alla clorexidina sappiamo tendere a tornare alle caratteristiche osservabili a seguito della sola strumentazione manuale34. È fondamentale perciò introdurre, successivamente alla decontaminazione con clorexidina, un principio attivo come l’ozono, in grado di favorire l’instaurarsi e il mantenimento di un equilibrio batterico, indispensabile per il raggiungimento di uno stato di salute parodontale35.
L’utilizzo di uno spazzolino sonico con fluidodinamica inoltre, come già descritto in precedenza, permette di disgregare il biofilm batterico fino a 2 mm sotto il margine gengivale, oltre che di veicolare i prodotti a base di ozono negli spazi interdentali e nel solco parodontale, zone normalmente difficili da raggiungere. In questo modo, oltre che incrementare il controllo di placca batterica, l’efficacia del principio attivo utilizzato viene potenziata.
L’insieme di questi fattori ha permesso di ottenere una riduzione dell’indice di sanguinamento dall’80% (t0) al 4% (t4); riduzione dell’indice di placca batterica dall’80% (t0) al 4% (t4); riduzione della profondità di sondaggio media da 3.2 mm (t0) a 1.9 mm (t4); livello di attacco clinico medio da 0.2 mm (t0) a 0.4 mm (t4).
Il trattamento eseguito non ha consentito tuttavia di portare l’elemento dentale 18 a miglioramento significativo dello stato parodontale, pertanto verrà tenuto sotto controllo per i 6 mesi successivi e, in assenza di progressi, si procederà all’estrazione.
Conclusione
I risultati ottenuti nel caso presentato sembrerebbero concordare con i risultati già ottenuti in altri trials, rispetto al protocollo MFMD, il quale prevede l’utilizzo di uno spazzolino sonico ad azione fluidodinamica associato a prodotti a base di ozono, che consentono di modificare l’ambiente del cavo orale, ridurre il carico infiammatorio e modulare il microbiota. Sia la terapia attiva che il mantenimento traggono notevole vantaggio dalla fase pre-trattamento descritta, in termini di indici parodontali, oltre che in termini di compliance e partecipazione del paziente, che assume sempre di più il ruolo di coprotagonista nel percorso verso uno stato di salute parodontale.
Bibliografia
- Tonetti MS, Greenwell H, Kornman KS. Staging and grading of periodontitis: Framework and proposal of a new classification and case definition. J Periodontol. 2018 Jun;89 Suppl 1:S159-S172. doi: 10.1002/JPER.18-0006. Erratum in: J Periodontol. 2018 Dec;89(12):1475.
- Hajishengallis, G. & Lamont, R. J. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol. Oral. Microbiol. 27, 409–419.
- Marsh, P.D.; Head, D.A.; Devine, D.A. Dental plaque as a biofilm and a microbial community—Implications for treatment. J. Oral Biosci. 2015, 57, 185–191.
- Hajishengallis, G. & Lamont, R. J. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol. Oral. Microbiol. 27, 409–419.
- Cobb, C.M. Clinical significance of non-surgical periodontal therapy: an evidence-based perspective of scaling and rootplaning. J. Clin. Periodontol. 29(Suppl 2), 6–16 (2002).
- Quirynen M, Mongardini C, de Soete M, et al. The role of chlorexidine in the one-stage full- mouth disinfection treatment of with advanced adult periodontitis. Long-term clinical and m logical observations. J Clin Periodontol. 2000;27:578-589.
- Genovesi AM, Marconcini S, Ricci M, Marchisio O, Covani F, U. Evaluation of a decontamination protocol prior to a full disinfection procedure: a randomized clinic al stud y. J Dent O 2014;6:77-84.
- Marconcini S, Goulding M, Oldoini G, Attanasio C, Giammarinaro E, Genovesi A. Clinical and patientcentered outcomes post non-surgical periodontal therapy with the use of a non-injectable anesth product: A randomized clinical study. J Investig Clin Dent. 2019 Nov;10(4):e12446.
- Cobb CM, Sottosanti JS. A re-evaluation of scaling and root planing. J Periodontol. 2021 Oct;92(10):1370-1378.
- Haffajee AD, Teles RP, Socransky SS. The effect of periodontal therapy on the composition of the subgingival microbiota. Periodontol 2000. 2006;42:219-58.
- James P, Worthington HV, Parnell C, Harding M, Lamont T, Cheung A, Whelton H, Riley P. Chlorhexidine mouthrinse as an adjunctive treatment for gingival health. Cochrane Database Syst Rev. 2017 Mar 31;3(3).
- Flötra L., Gjermo P., Rölla G., Waerhaug J.. Side effects of chlorhexidine mouth washes. Scand J Dent Res 1971; 79(2):119-25.
- Colombo M, Gallo S, Garofoli A, Poggio C, Arciola CR, Scribante A. Ozone Gel in Chronic Periodontal Disease: A Randomized Clinical Trial on the Anti-Inflammatory Effects of Ozone Application. Biology (Basel). 2021 Jul 6;10(7):625.
- Monzillo, V.; Lallitto, F.; Russo, A.; Poggio, C.; Scribante, A.; Arciola, C.R.; Bertuccio, F.R.; Colombo, M. Ozonized Gel Against Four Candida Species: A Pilot Study and Clinical Perspectives. Materials (Basel) 2020, 13, 1731.
- Huth KC, Jakob FM, Saugel B, Cappello C, Paschos E, Hollweck R, Hickel R, Brand K. Effect of ozone on oral cells compared with established antimicrobials. Eur J Oral Sci. 2006 Oct;114(5):435-40.
- Seidler V, Linetskiy I, Hubálková H, Stanková H, Smucler R, Mazánek J. Ozone and its usage in general medicine and dentistry. A review article. Prague Med Rep. 2008;109(1):5-13.
- Oldoini G, Ricci Frabattista G, Saragoni M, Cosola S, Giammarinaro E, Genovesi AM, Marconcini S. Ozone theraphy for oral palatal ulcer in a leukaemic patient. EJCRIM 2020;7.
- Srikanth A, Sathish M, Sri Harsha AV. Application of ozone in the treatment of periodontal disease. J Pharm Bioallied Sci. 2013 Jun;5(Suppl 1):S89-94.
- Valacchi G, Bocci V. Studies on the biological effects of ozone: 11. Release of factors from human endothelial cells. Mediators Inflamm. 2000;9(6):271-6.
- Van Dyke TE, Serhan CN. Resolution of inflammation: a new paradigm for the pathogenesis of periodontal diseases. Journal of Dental Research 2003;82:82–90.
- Bartold, P. M. (2018). Lifestyle and periodontitis: The emergence of personalized periodontics. Periodontology 2000, 78(1), 7–11. doi:10.1111/prd.1223721.
- Deepthi R, Bilichodmath S. Ozone Therapy in Periodontics: A Meta-analysis. Contemp Clin Dent. 2020 Apr-Jun;11(2):108-115.
- Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol. 2010 Jul;8(7):481-90.
- Nambiar S, Malothu S, Karmakar S, Varkey A, Chandra D, Chava VK. Comparison of Ozonated Olive Oil and Chlorhexidine Gel as an Adjunct to Nonsurgical Periodontal Therapy for the Treatment of Chronic Periodontitis: A Randomized Controlled Clinical Trial. J Pharm Bioallied Sci. 2022 Jul;14(Suppl 1):S94-S98.
- Van der Weijden FA, Slot DE. Efficacy of homecare regimens for mechanical plaque removal in managing gingivitis -a meta review. J Clin Periodontol 2015; 42 (Suppl.16) S77-S91.
- Hansen, F. & Gjermo, P. The plaque- removal effect of four toothbrushing methods. Scandinavian Journal of Dental Research. 1971; 79(7): 502–506.
- Preda C, Butera A, Pelle S, Pautasso E, Chiesa A, Esposito F, Oldoini G, Scribante A, Genovesi AM, Cosola S. Correction: Preda et al. The Efficacy of Powered Oscillating Heads vs. Powered Sonic Action Heads Toothbrushes to Maintain Periodontal and Peri-Implant Health: A Narrative Review. Int. J. Environ. Res. Public Health 2021, 18, 1468. Int J Environ Res Public Health. 2022 Sep 29;19(19):12389.
- Schmidt JC, Zaugg C, Weiger R, Walter C. Brushing without brushing? A review of the efficacy of powered toothbrushes in noncontact biofilm removal. Clin Oral Investig. 2013 Apr;17(3):687-709.
- Sechi, L.A.; Lezcano, I.; Nunez, N.; Espim, M.; Duprè, I.; Pinna, A.; Molicotti, P.; Fadda, G.; Zanetti, S. Antibacterial activity of ozonized sunflower oil (Oleozon). J. Appl. Microbiol. 2001, 90, 279–284.
- Petersilka GJ. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 2011 Feb;55(1):124-42.
- Sanz I, Alonso B, Carasol M, Herrera D, Sanz M. Nonsurgical treatment of periodontitis. J Evid Based Dent Pract. 2012;12:76‐86. 24.
- Marconcini S, Goulding M, Oldoini G, Attanasio C, Giammarinaro E, Genovesi A. Clinical and patient‐centered outcomes post non‐surgical periodontal therapy with the use oaf a non‐injectable anesthetic product: A randomized clinical study. J Invest Clin Dent. 2019;10:e12446.
- Derman SH, Lowden CE, Kaus P, Noack MJ. Pocket‐depths‐related effectiveness of an intrapocket anaesthesia gel in periodontal main‐tenance patients. Int J Dent Hyg. 2014;12:141‐144. 25.
- Sekino S, Ramberg P, Guzin Uzel N, Socransky S, Lindhe J. The effect of a chlorhexidine regimen on de novo plaque formation. J Clin Periodontol. 2004;31:609‐614.
- Magnusson I, Lindhe J, Yoneyama T, Liljenberg B. Recolonization of a subgingival microbiota following scaling in deep pockets. J Clin Periodontol. 1984;11:193.